Аллопластика при вентральных грыж

- Авторы
- Резюме
- Файлы
- Ключевые слова
Васильев М.Н., Ванюшин П.Н., Григорьев К.Ю., Морозов В.С.
Предложен способ комбинированной аллогерниопластики послеоперационных срединных вентральных грыж. Предусмотренное этим способом расположение эксплантата внутри дупликатуры, образованной листками и лоскутами влагалищ прямых мышц живота, позволяет исключить вероятность развития осложнений, характерных для подкожного и предбрюшинного расположения эксплантата. С использованием предлагаемого способа оперировано 7 пациентов, получены удовлетворительные результаты, рецидивов не отмечено.
послеоперационная грыжа
аллопластика
Введение
Лечение послеоперационных вентральных грыж остается актуальной задачей абдоминальной хирургии. Это заболевание возникает у 2‒20 % больных, перенесших лапаротомию, и по частоте занимает второе место после паховых грыж [2]. В современной герниологии чаще используют синтетические материалы [4].
Частота раневых осложнений после пластики передней брюшной стенки по поводу послеоперационной вентральной грыжи варьирует от 20,9 до 67 % [4]. Существует мнение, что применение сетчатых протезов увеличивает частоту раневых осложнений.
В настоящее время при пластике грыж эндопротез используют в одном из нескольких вариантов расположения по отношению к мышечно-апоневротическому слою передней брюшной стенки on lay или sub lay.
Основным недостатком пластики сетчатым протезом является развитие послеоперационных осложнений: нагноение, серома, гематома, отторжение протеза, формирование кишечных спаек и свищей [3‒5].
Эти обстоятельства побудили нас искать способ, позволяющий улучшить результаты лечения послеоперационных вентральных грыж, снизив количество послеоперационных осложнений.
Цель исследования
Оценить результаты применения разработанного способа пластики передней брюшной стенки у больных с послеоперационными срединными вентральными грыжами.
Материал и метод исследования
В исследование были включены 50 больных, оперированных в плановом порядке в хирургическом отделении ГУЗ УОКБ за период с 2007 по 2010 гг. Все пациенты были женского пола, у всех грыжи сформировались после верхнесрединной лапаротомии. В основную группу вошли 7 пациентов, оперированных по разработанной нами методике (заявка на изобретение № 2010112912). В контрольную группу включили 43 пациента, оперированных по методике on lay. Обе группы были сопоставимы по возрасту (средний возраст в основной группе — 56,57 лет, средний возраст в контрольной группе — 57,65 лет), размерам грыжевого дефекта (по классификации J.Chevrel-A.Rath, в основной группе W1 — 2 больных (28,8 %), W2 — 5 больных (71,2 %); в контрольной группе W1 — 13 больных (30,2 %), W2 — 30 больных (69,8 %)). В основной группе различная сопутствующая патология встречалась у 4 пациентов (57,14 %), в контрольной группе — у 27 (62, 8 %).
Разработанный нами метод осуществляется следующий образом. Двумя окаймляющими разрезами в проекции грыжи рассекают кожу с подкожной клетчаткой (рис. 1, 2), выделяют грыжевой мешок до грыжевых ворот. Грыжевой мешок вскрывают и выполняют внутрибрюшной этап операции (рассечение спаек, ликвидация непроходимости, симультанные операции на внутренних органах). Потом производят сшивание без натяжения между собой брюшины и рассеченных оболочек грыжевого мешка, в зависимости от размеров, «край в край» или с формированием дупликатуры.
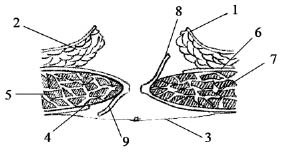
Рис. 1. 1 — кожа; 2 — подкожная клетчатка;
3 — лоскут переднего листка влагалища левой прямой мышцы живота; 4 — передний листок влагалища
левой прямой мышцы живота; 5 — левая прямая
мышца живота; 6 — ушитые листки брюшины;
7 — лоскут заднего листка влагалища правой прямой мышцы живота; 8 — задний листок влагалища
правой прямой мышцы живота;
9 — правая прямая мышца живота
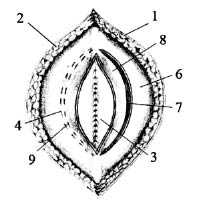
Рис. 2. 1 — кожа; 2 — подкожная клетчатка; 3 — лоскут переднего листка
влагалища левой прямой мышцы
живота; 4 — передний листок
влагалища левой прямой мышцы
живота; 6 — ушитые листки брюшины; 7 — лоскут заднего листка влагалища правой прямой мышцы живота;
8 — задний листок влагалища правой прямой мышцы живота;
9 — правая прямая мышца живота
Необходимый участок заднего листка влагалища правой прямой мышцы живота освобождают на всю длину грыжевого дефекта, отслаивая подлежащую брюшину. Необходимый участок переднего листка влагалища левой прямой мышцы живота освобождают от подкожной клетчатки на всю длину грыжевого дефекта.
Таким образом, изолировав брюшную полость и освободив необходимые участки листков влагалищ прямых мышц живота, переходят непосредственно к пластике.
Сначала, отступив на 1-1,5 см от края грыжевых ворот, выполняют полуовальный разрез переднего листка влагалища левой прямой мышцы живота на всю длину грыжевого дефекта, затем такого же размера полуовальный разрез заднего листка влагалища правой прямой мышцы живота (рис. 1, 2). Расправляют лоскут переднего листка влагалища левой прямой мышцы живота и лоскут заднего листка влагалища правой прямой мышцы живота.
Затем расправленный лоскут переднего листка влагалища левой прямой мышцы живота сшивают с задним листком влагалища правой прямой мышцы живота.
После этого выкраивают сетчатый эксплантат в виде буквы Н. Размеры сетчатого эксплантата по ширине превышают на 1-2 см края швов лоскутов влагалищ прямых мышц живота, а по длине — на 1,5-2 см больше грыжевого дефекта. Формируют ложе для расположения сетчатого эксплантата, образованное расправленным лоскутом переднего листка влагалища левой прямой мышцы живота и задним листком влагалища правой прямой мышцы живота путем частичного отслаивания правой и левой прямых мышц живота. Сетчатый эксплантат укладывают под правую и левую прямые мышцы живота на сформированное ложе, верхние и нижние концы сетчатого эксплантата располагают за края ушитого дефекта в соответствующих влагалищах прямых мышц живота и без натяжения подшивают его по периметру и по центру к сформированному ложу с помощью синтетических нитей редкими узловыми швами. Затем поверх сетчатого эксплантата правой и левой прямых мышц живота ушивают расправленный лоскут заднего листка влагалища правой прямой мышцы живота с передним листком влагалища левой прямой мышцы живота (рис. 3, 4). Таким образом, формируют дупликатуру, образованную листками и лоскутами влагалищ прямых мышц живота. Операцию завершают установкой дренажей внутри дупликатуры для последующей вакуумной аспирации. Кожную рану зашивают.
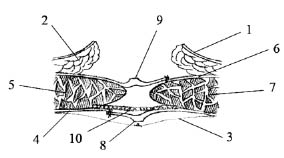
Рис. 3. 1 — кожа; 2 — подкожная клетчатка;
3 — лоскут переднего листка влагалища левой прямой мышцы живота; 4 — передний листок влагалища левой прямой мышцы живота; 5 — левая прямая мышца
живота; 6 — ушитые листки брюшины; 7 — лоскут
заднего листка влагалища правой прямой мышцы
живота; 8 — задний листок влагалища правой прямой мышцы живота; 9 — правая прямая мышца живота;
10 — имплантат (эндопротез)
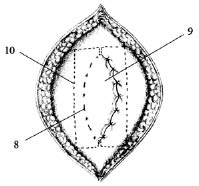
Рис. 4. 8 — задний листок влагалища правой прямой мышцы живота;
9 — правая прямая мышца живота;
10 — имплантат (эндопротез)
В качестве сетчатого эксплантата в обеих группах использовались полипропиленовая сетка и шовный материал пролен.
Все пациенты проходили тщательное догоспитальное обследование и осмотр смежных специалистов. Проводилась предоперационная подготовка с учетом сопутствующей патологии. Всем больным проводилась неспецифическая профилактика тромбоэмболических осложнений: эластическая компрессия нижних конечностей, ранняя активизация больных. При наличии факторов риска производилось введение низкомолекулярного гепарина: начиная с первых 12 часов после операции и в течение 5-7 дней послеоперационного периода. Для профилактики послеоперационных раневых осложнений за 30 минут до операции или интраоперационно вводились антибиотики цефалоспоринового ряда. Во всех случаях выполнялось дренирование раны в течение 2-5 дней. В послеоперационном периоде выполнялся ультразвуковой контроль течения раневого процесса на 3, 10 сутки.
Результаты исследования и их обсуждение
Среднее количество койко-дней в основной группе было 12,3, в контрольной группе — 16,26. В основной группе раневых послеоперационных осложнений не наблюдалось. В контрольной группе осложнения отмечены у 7 — (16,28 %) пациентов. У 2 — (4,66 %) — длительная серозная экссудация из раны, у 1 — (2,33 %) некроз краев раны, у 1 — (2,33 %) инфильтрат. Гематома наблюдалась у 3 — (6,96 %) пациентов контрольной группы, из которых в одном случае гематома была инфицированная. При анализе причин инфицирования было выяснено, что присутствовала инфекция в зоне оперативного вмешательства (гнойные гранулемы). В послеоперационном периоде в контрольной группе умерла 1 (2,33 %) больная от острого нарушения мозгового кровообращения. Летальных случаев в основной группе не было. Рецидивов грыж в обеих группах не отмечено (сроки наблюдения основной группы
9 месяцев, контрольной группы до 3 лет).
Выводы
Использование предложенного способа позволяет выполнить пластику дефектов стенки живота без значительного уменьшения объема брюшной полости, уменьшить число послеоперационных раневых осложнений и летальных исходов.
Список литературы
- Войленко В.Н., Меделян А.И., Омельченко В.М. Атлас операций на брюшной стенке и органах брюшной полости — М.: Медицина, 1965. — 608 с.
- Деметриашвили З.М., Магалашвили Р.Д., Лобжанидзе Г.В. Лечение послеоперационных вентральных грыж// Хирургия. — 2008. — №11. — С. 44-46.
- Загиров У.З., Салихов М.А., Исаев У.М. Анатомо-функциональное обоснование нового способа комбинированной пластики срединных вентральных грыж // Хирургия. — 2008. — №7. — С. 41-42.
- Мирзабекян Ю.Р., Добровольский С.Р. Прогноз и профилактика раневых осложнений после пластики передней брюшной стенки по поводу послеоперационной вентральной грыжи // Хирургия. — 2008. — №1. — С. 66-71.
- Нелюбин П.С., Галота Е.А., Тимошин А.Д. Хирургическое лечение больных с послеоперационными и рецидивными вентральными грыжами // Хирургия. — 2007. — №7. — С. 69-74.
- Тоскин К.Д., Жебровский В.В. Грыжи живота. — М.: Медицина, 1983. — 240 с.
Библиографическая ссылка
Васильев М.Н., Ванюшин П.Н., Григорьев К.Ю., Морозов В.С. СПОСОБ АЛЛОПЛАСТИКИ ПОСЛЕОПЕРАЦИОННЫХ ВЕНТРАЛЬНЫХ ГРЫЖ // Фундаментальные исследования. – 2010. – № 11. – С. 33-36;
URL: https://fundamental-research.ru/ru/article/view?id=14012 (дата обращения: 22.08.2020).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Послеоперационные вентральные грыжи являются одним из наиболее частых осложнений после абдоминальных операций и имеют важное социально-экономическое значение [4, 7, 11, 13, 14]. С появлением протезов на основе полипропилена аллопластика стала методом выбора в лечении послеоперационных, в частности рецидивных, больших и гигантских грыж [5, 15]. Тем не менее выбор оптимального способа аллопластики остается предметом дискуссии.
Хотя качество жизни (КЖ) больных является одним из основных критериев эффективности способов пластики послеоперационных вентральных грыж, имеются лишь единичные исследования, в которых изучается эта проблема [6].
Целью исследования явилась сравнительная оценка результатов открытой аллопластики с использованием технологии по onlay и sublay у больных с большой и гигантской послеоперационными вентральными грыжами.
Проанализированы результаты аллопластики у 118 больных с большой или гигантской послеоперационной вентральной грыжей. Большой считали грыжу, полностью занимающую одну область передней брюшной стенки и деформирующую живот; грыжу, занимающую две или более области, резко деформирующую живот и мешающую больному ходить, оценивали как гигантскую [7, 8]. Большая грыжа имела место у 82 (69,5%), гигантская — у 36 (30,5%) больных.
Сопутствующие заболевания, требующие хирургического лечения, были выявлены у 22 (18,6%) больных (рис. 1). Рисунок 1. Фотография в анфас (а) больной А., 55 лет, с гигантской послеоперационной вентральной грыжей, сочетающейся с варикозной болезнью вен нижних конечностей и ожирением IV степени.
Рисунок 1. Фотография в анфас (а) больной А., 55 лет, с гигантской послеоперационной вентральной грыжей, сочетающейся с варикозной болезнью вен нижних конечностей и ожирением IV степени. Рисунок 1. Фотография в профиль (б) больной А., 55 лет, с гигантской послеоперационной вентральной грыжей, сочетающейся с варикозной болезнью вен нижних конечностей и ожирением IV степени.
Рисунок 1. Фотография в профиль (б) больной А., 55 лет, с гигантской послеоперационной вентральной грыжей, сочетающейся с варикозной болезнью вен нижних конечностей и ожирением IV степени.
Алломатериал на основе полипропилена имплантировали двумя способами: 1) onlay — размещали между подкожной жировой клетчаткой и апоневрозом — 64 (54,2%) больных, 2) sublay — во влагалище прямых мышц живота — 54 (45,8%) больных.
Операции выполняли под комбинированной общей анестезией. В части наблюдений использовали ультразвуковые ножницы и скальпель, что позволяло достичь надежного гемостаза и предотвратить лимфорею, исключало необходимость лигирования сосудов, значительно сокращало продолжительность операции.
Согласно мнению Европейского общества герниологов, после пластики брюшной стенки у больных с послеоперационной вентральной грыжей все операции должны завершаться дренированием раны трубками, соединенными с аппаратом для постоянной аспирации [14]. Исходя из этого, при образовании большой остаточной полости зашивали рану с установкой дренажей (как правило, от 1 до 3), которые фиксировали в раневой полости в наиболее рациональном положении с помощью рассасывающегося шовного материала. При последующих УЗИ раны контролировали положение дренажей и их функционирование.
КЖ больных оценивали через год после хирургического лечения. Для этого больные заполняли опросник SF-36 [17], после чего ответы вводили в компьютер со специальной программой. Больные, умеющие пользоваться компьютером, отвечали на вопросы, сидя непосредственно перед компьютером и заполняя анкету в присутствии врача.
При проведении статистической обработки данных использовали программу SPSS (SPSS, Chicago, IL, USA). При значении p<0,05 различие было принято статистически значимым.
Осложнения после операции встречались у 36 (30,5%) больных. У 94,4% больных (34 наблюдения) были раневые осложнения. Серома наблюдалась у 20 (16,9%), гематома — у 3 (2,5%), раневая инфекция — у 6 (5,1%) и краевой некроз кожи — у 5 (4,2%) больных (табл. 1).
Серома наблюдалась в основном после пластики onlay (рис. 2). Рисунок 2. УЗИ мягких тканей передней брюшной стенки. Серома над полипропиленовой сеткой. а — до пункции.
Рисунок 2. УЗИ мягких тканей передней брюшной стенки. Серома над полипропиленовой сеткой. а — до пункции. Рисунок 2. УЗИ мягких тканей передней брюшной стенки. Серома над полипропиленовой сеткой. б — после пункции и эвакуации около 120 мл жидкости. Пунктирными стрелками указана серома, остальными — алломатериал.
Рисунок 2. УЗИ мягких тканей передней брюшной стенки. Серома над полипропиленовой сеткой. б — после пункции и эвакуации около 120 мл жидкости. Пунктирными стрелками указана серома, остальными — алломатериал.
Риск образования серомы может быть значительно снижен при расположении протеза ретромускулярно и постоянной эвакуации раневого отделяемого с помощью дренажей [9]. Лишь у 2 больных, которым имплантировали протез с использованием технологии sublay и проводили активную аспирацию, образовалась серома. Ее ликвидировали с помощью пункций под контролем УЗИ, играющего важную роль в диагностике и профилактике раневых осложнений [2, 3, 16]. После уменьшения количества эвакуируемой жидкости пункцию прекращали.
Раневая инфекция в 5 наблюдениях разрешилась в стадии образования инфильтрата, у 1 больного рана нагноилась. В последнем наблюдении рану вели соответственно правилам лечения гнойных ран, сетку не удаляли. Гематомы (3 больных) разрешились после однократной пункции.
При развитии краевых некрозов (5 больных) экономно иссекали некротизированную кожу и накладывали вторичные швы.
У 2 больных после аллопластики onlay развилась пневмония, которую купировали с помощью консервативного лечения. Летального исхода не было.
Отдаленные результаты аллопластики изучили у 82 больных, в том числе 44 перенесли пластику onlay и у 38 — sublay.
Срок наблюдения составил от 1 года до 5 лет. На контрольное обследование по вызову явились 62 больных, перенесших аллопластику. При отказе от обследования или невозможности прийти на обследование присылали анкету, содержащую специфические вопросы. На анкетные вопросы ответили 20 больных. После выяснения жалоб, изучения медицинских документов перешли к непосредственному обследованию, включавшему, кроме физикальных методов исследования, УЗИ области операции.
Согласно данным литературы, частота рецидивов после пластики послеоперационных вентральных грыж колеблется в пределах 18-54%, после внедрения аллопластики этот показатель снизился до 10% [10, 12]. Как правило, число рецидивов гораздо меньше при имплантации протезов, чем при других способах [1]. В нашем исследовании рецидив грыжи был выявлен у 7 (10,9%) больных после пластики onlay, тогда как после пластики sublay рецидива не наблюдали (р=0,034). Основное количество рецидивов приходилось на первые 2 года. Всем больным производили повторную операцию. При ревизии было выявлено, что у 2 больных грыжа локализовалась по верхнему краю, у 3 — по нижнему краю имплантированной сетки по линии послеоперационного рубца, у 2 больных с ожирением она располагалась в центре имплантированной сетки, также по линии послеоперационного рубца. В 3 наблюдениях дополнительно имплантировали сетку, покрывающую вновь образовавшиеся грыжевые ворота, в 3 наблюдениях подшивали новую сетку поверх старой, у 1 больного пришлось удалить инфицированный протез.
При контрольном обследовании больные отвечали на специфические вопросы, отражающие локальный статус и связанные непосредственно с перенесенной операцией. На каждый вопрос следовал один из двух альтернативных ответов (есть, нет). Показатели локального статуса после аллопластики приведены в табл. 2.
Как видно из табл. 2, количество оперированных с болью в области операции, ограничением подвижности брюшной стенки и ощущением инородного тела было статистически значимо меньше после пластики sublay.
В табл. 3 даны показатели КЖ по SF-36 через год после аллопластики.
даны показатели КЖ по SF-36 через год после аллопластики.
Как видно из табл. 3, пластика sublay по всем показателям КЖ значительно превосходит пластику onlay. Наши исследования показали, что через год после аллопластики sublay КЖ больных значительно лучше.
Таким образом, общее количество больных с осложнениями, в частности с серомами, было статистически меньше после пластики sublay. У этих больных отмечались наилучшие показатели локального статуса и КЖ через год после операции. После аллопластики sublay рецидива грыжи не было выявлено.
Для объективной оценки преимуществ и недостатков того или иного способа аллопластики при большой и гигантской послеоперационных вентральных грыжах требуются дальнейшие рандомизированные контролируемые исследования на большом клиническом материале.
Источник


