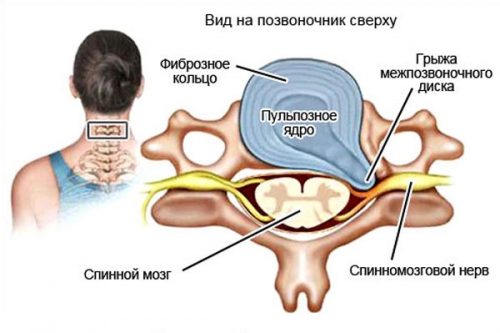
Нимесил после операции грыжи
Нестероидные противовоспалительные препараты (НПВП) имеют большое значение в лечении болей после оперативных вмешательств. НПВП могут применяться для снижения потребности в опиоидах после крупных вмешательств или в качестве монотерапии для контроля над болью после небольших операций [1]. Следует отметить, что наряду с достаточно высокой эффективностью применение НПВП также характеризуется и хорошо известными побочными эффектами. Наибольшее значение в послеоперационном периоде имеет повышение риска кровотечения. Подобный эффект вызван подавлением способности тромбоцитов к агрегации вследствие угнетения активности фермента циклооксигеназа–1 (ЦОГ–1) [2–4]. В этой связи применение неселективных НПВП в периоперационном периоде ограничено. Риск послеоперационного кровотечения ниже в случае использования препаратов, оказывающих более выраженное действие на ЦОГ–2 [3,4]. Нимесулид является НПВП с обезболивающим, противовоспалительным и жаропонижающим действием. Механизм действия данного препарата не ограничивается влиянием на ЦОГ–2 и включает большое количество других биохимических процессов, таких как угнетение фосфодиэстеразы IV, активности нейтрофилов, а также антиоксидантное действие в хондроцитах. Существует достаточное количество данных, указывающих на важность этих медиаторов в развитии воспалительных и болевых реакций, что делает нимесулид уникальным препаратом с множественными механизмами действия [5,6].
Эффективность нимесулида в лечении болей продемонстрирована у пациентов с артритом, болями в спине и мышечно–костными повреждениями [7–13]. Более того, было отмечено, что скорость наступления обезболивающего эффекта при применении нимесулида может превышать таковую для других анальгетиков [7,8], что имеет большое значение в послеоперационном периоде. Также было установлено, что пациенты хорошо переносят нимесулид и частота развития побочных эффектов со стороны желудочно–кишечного тракта при применении нимесулида ниже по сравнению с напрокселом, индометацином и диклофенаком [5,14,15]. Нимесулид в терапевтической дозе 200 мг не увеличивает время кровотечения и не оказывает клинически значимого влияния на коагуляцию [14,16].
В нескольких исследованиях изучена эффективность нимесулида в лечении болей после стоматологических и отоларингических вмешательств, а также операций по поводу геморроя [17–22]. Результаты этих исследований показали, что нимесулид обеспечивает, как минимум, не худшее обезболивание по сравнению с нифлумовой кислотой, диклофенаком, ибупрофеном и напроксеном, однако эффект нимесулида развивается быстрее.
Целью настоящего исследования являлось изучение анальгетической активности и переносимости нимесулида по сравнению с напроксеном и плацебо у пациентов после амбулаторных ортопедических вмешательств.
Методы
Пациенты
Исследование включало пациентов обоих полов в возрасте от 18 до 75 лет. Всем пациентам были выполнены артроскопия или менискэктомия под общей анестезией, и они находились в больнице не менее 6 ч после операции. Пациенты с не менее чем умеренными болями были рандомизированы на получение различных препаратов. В исследование не включали пациентов с аллергией на нестероидные противовоспалительные препараты, а также тех, кто принимал подобные препараты в течение 24 ч (для препаратов короткого действия) или недели (для препаратов длительного действия) до операции. Также были исключены пациенты, получавшие лечение препаратами, обладающими гепатотоксической активностью, и страдающие язвенной болезнью или хронической диспепсией. Наркоз проводили с применением внутривенного фентанила 0,1 мг или альфентанила 1 мг. Местное обезболивание в области операции не выполняли.
Дизайн исследования
Данное исследование было многоцентровым рандомизированным дважды слепым плацебо–контролируемым с параллельными группами. При проведении исследования учитывались принципы, изложенные в Хельсинкской декларации. До начала исследования было получено разрешение от местных этических комитетов, и все участники исследования подписывали информированное согласие.
Пациенты, испытывавшие послеоперационную боль не менее чем средней тяжести (согласно вербальной шкале с 5 пунктами), были рандомизированы на получение нимесулида 100 мг, напроксена 500 мг или плацебо. Повторная доза препарата была разрешена не ранее чем через 8 ч после первой. Исследуемый препарат разрешено было принимать не чаще чем 2 раза/сут. до 3 дней. Если пациенты нуждались в дополнительном обезболивании они принимали парацетамол в дозе 500 мг до 6 раз/сут.
Параметры эффективности
Интенсивность болей оценивали с применением вербальной шкалы, а также 100–миллиметровой визуальной аналоговой шкалы (ВАШ) исходно (до приема препарата), а также через 15, 30, 45, 60, 90, 120 и 180 мин. и через 3, 4, 5, 6 и 8 ч после приема. Для последующих доз препарата интенсивность болевых ощущений оценивали сразу перед и через 2 ч после каждой дозы. При вербальной оценке пациента просили описать испытываемую боль как отсутствующую полностью, умеренную, средней тяжести, сильную или очень сильную. Основным оценивавшимся показателем было изменение суммарной интенсивности боли (ИСИБ 0–6) в период с 0 до 6 ч после приема первой дозы препарата, который рассчитывали на основании измерений через 5 и 30 мин., а также 1, 2, 3, 4, 5 и 6 ч. ИСИБ 0–6 рассчитывали по следующей формуле:
ΣСИБ*(время, прошедшее с предыдущего измерения).
Дальнейший анализ включал значения ИСИБ, рассчитанные с применением дополнительных временных интервалов между 6 и 8–ю ч. В 100–миллиметровой ВАШ интенсивность боли оценивали по шкале от 0 (боли нет) до 100 (самая сильная боль). Вторичные показатели эффективности, основанные на данных ВАШ, включали временные интервалы до 20 и 50% снижения интенсивности боли.
Оценку обезболивания проводили в то же время, когда исследовали интенсивность боли. Пациентов просили оценить выраженность обезболивания как отсутствующую, слабую, умеренную, хорошую или полную. Вторичный анализ эффективности обезболивания включал общее снижение боли в течение 6 и 8 ч (ОСБ 0–6 и ОСБ 0–8) и максимальное снижение боли. ОСБ определяли как:
ΣОСБ*(время, прошедшее с предыдущего измерения).
Оценку интенсивности боли выполняли в спокойном положении пациентов. Пациенты и исследователи также оценивали общую эффективность лечения как очень хорошую, хорошую, достаточную, плохую или очень плохую. Также у пациентов выясняли наличие побочных эффектов.
Статистический анализ
Основным элементом анализа эффективности являлось сравнение ИСИБ 0–6 в группах, получавших плацебо и нимесулид. При оценке результатов применяли ковариационный анализ. При оценке вторичных показателей эффективности для попарного сравнения трех групп также использовали ковариационный анализ. Время до 20 и 50% снижения интенсивности боли, а также до приема первого дополнительного препарата сравнивали с применением метода Каплан–Мейер. Результаты оценки общей эффективности сравнивали с помощью теста Фишера.
Результаты
Среди 111 пациентов, включенных в исследование, 94 отмечали, как минимум, умеренную послеоперационную боль и были рандомизированы на получение нимесулида (n=29), напроксена (n=34) и плацебо (n=31). Данные 88 пациентов были достаточными для включения в итоговый анализ. Характеристики пациентов, получавших различное лечение, не имели существенных различий (табл. 1).
Основной анализ эффективности
Нимесулид достоверно превосходил плацебо в снижении интенсивности болей в течение первых 6 ч лечения. Средние значения ИСИБ для нимесулида и плацебо составили 10,91 и 6,29 соответственно (рис. 1). В то же время эффективность напроксена была сходной с плацебо.
Вторичные показатели эффективности
Снижение интенсивности боли при применении нимесулида также достоверно превышало таковое для напроксена по данным ИСИБ 0–6 (10,91 и 7,07 соответственно, р=0,003) (рис. 1). При включении в анализ дополнительных временных периодов нимесулид продолжал превосходить по эффективности как плацебо, так и напроксен (10,56, 6,10 и 6,85 соответственно, р<0,001 и р=0,003). Статистически достоверных различий между напроксеном и плацебо не отмечено. По показателю ИСИБ 0–8 нимесулид также был значительно эффективнее напроксена (14,41 и 8,61, р=0,016), однако в связи со значительными колебаниями в эффективности плацебо последняя не отличалась от таковой для нимесулида.
Среднее различие в интенсивности боли по сравнению с исходными показателями, оценивавшееся по данным устной шкалы и ВАШ (рис. 2 А, В), было значительно выше в случае нимесулида по сравнению с напроксеном и плацебо (р<0,05). Данные различия становились достоверными через 1 час по данным устной шкалы и через 1,5 ч по данным ВАШ. Ни на одном из временных промежутков напроксен не отличался от плацебо. Максимальные различия в интенсивности боли также были выше в случае нимесулида по сравнению с напроксеном и плацебо (табл. 2).
Медиана временного интервала до 50–процентного снижения интенсивности боли была значительно ниже среди пациентов, получавших нимесулид (0,82 ч) по сравнению с принимавшими напроксен (1,05 ч, р=0,017) или плацебо (1,33 ч, р=0,001) (рис. 3). По истечении 1 ч более 70% пациентов, получавших нимесулид, отмечали не менее чем 50–процентное снижение интенсивности боли, в то время как среди получавших напроксен и плацебо данный показатель составил 50 и 40% соответственно. В то же время период до достижения 20–процентного снижения интенсивности боли не зависел от принимаемого препарата.
Максимальное снижение интенсивности боли было значительно большим у пациентов, получавших нимесулид (табл. 2). Общее снижение боли в течение первых 6 ч также было значительно более выраженным при приеме нимесулида по сравнению с напроксеном и плацебо. Общее снижение боли в течение первых 8 ч было большим среди получавших нимесулид, однако различие с другими группами не было статистически достоверным (табл. 2).
Число пациентов, которые нуждались в приеме дополнительных препаратов в период с 1 до 8 ч после хирургического вмешательства, представлено на рисунке 4. В целом потребность в дополнительном лечении была ниже в группе, получавшей нимесулид. В общей сложности лишь 27,6% пациентов, получавших нимесулид, нуждались в приеме парацетамола в день операции, в то время как среди получавших плацебо и напроксен этот показатель составил 64,5 и 47,1% соответственно.
Большинство пациентов и исследователей положительно ответили на вопрос об общем впечатлении от лечения и положительно оценили его эффект («как хороший» и «очень хороший»). Частота положительных оценок была более высокой среди получавших нимесулид по сравнению с напроксеном.
Побочные эффекты
В целом оба препарата переносились хорошо. Наиболее частым побочным эффектом были желудочно–кишечные расстройства, включая диспепсию у 6,5% пациентов, получавших плацебо, и тошноту у 5,9% пациентов, получавших напроксен. Общее количество побочных эффектов и процент пациентов, сообщавших об их развитии, были ниже в группе, получавшей нимесулид. Более того, ни один из пациентов, принимавших нимесулид, не отметил желудочно–кишечных нарушений. Серьезных побочных эффектов среди пациентов, получавших нимесулид и напроксен, не отмечено. Желудочно–кишечные нарушения, развившиеся у участников исследования, представлены в таблице 3.
Обсуждение
Настоящее исследование показало, что нимесулид обладает выраженной анальгетической активностью у пациентов с умеренными и сильными болями после артроскопических ортопедических вмешательств. Нимесулид превзошел плацебо по основному оцениваемому показателю ИСИБ 0–6. Кроме того, он также оказался более эффективным, чем напроксен, не только в отношении скорости начала действия, но и по многим вторичным показателям эффективности, включая общее снижение боли и максимальное различие в интенсивности боли.
Эти данные оказались неожиданными. Напроксен является стандартным постоперационным анальгетиком [23–28], однако в рамках настоящего исследования его эффективность не превысила плацебо. Возможным объяснением данного факта является необычно выраженный анальгетический эффект плацебо, имевший место в данном исследовании. По литературным данным, прием плацебо приводит к значениям ИСИБ 0–6 около 2,1, однако в нашем исследовании данный показатель составил 6,29. Возможно, что боль после артроскопических вмешательств снижалась с такой скоростью, что эффект плацебо был преувеличен. Это также могло повлиять на прием дополнительных препаратов пациентами из групп напроксена и плацебо. В то же время значение ИСИБ 0–6 для напроксена 7,07 вполне согласуется с результатами других работ [27–29].
Высокая скорость начала действия нимесулида имеет большое значение именно в клинических условиях, имевших место в нашей работе. Эффективное послеоперационное обезболивание является крайне важным для быстрой выписки пациентов после амбулаторных хирургических вмешательств. Также важным для препаратов, применяемых в подобных условиях, является низкое число побочных эффектов. В настоящем исследовании частота побочных эффектов была достаточно низкой во всех трех группах. Заслуживает внимания тот факт, что ни один из пациентов, получавших нимесулид, не отметил каких–либо желудочно–кишечных побочных эффектов. Таким образом, настоящее исследование убедительно доказывает, что нимесулид является эффективным, быстродействующим и хорошо переносимым пероральным противовоспалительным препаратом, обладающим выраженной анальгетической активностью у пациентов после амбулаторных артроскопических вмешательств на колене.
Реферат подготовлен к.м.н. В.В. Иремашвили
по материалам статьи Alexander Binning
«Nimesulide in the Treatment of Postoperative Pain:
A Double–blind, Comparative Study in Patients Undergoing Arthroscopic Knee Surgery» Clinical Journal of Pain
Volume 23 Number 7 2007 pp. 565–570
Литература
1. Chen LC. Elliott RA, Ashcroft DM. Systematic review of the analgesic efficacy and tolerability of COX–2 inhibitors in postoperative pain control. J Clin Pharm Ther. 2004;29:215–229.
2. Ekman EF, Wahba M, Ancona F. Analgesic efficacy of perioperative celecoxib in ambulatory arthroscopic knee surgery: a doubleblind, placebo–controlled study. Arthroscopy. 2006;22:635–642.
3. Strom BL, Berlin JA, Kinman JL, et al. Parenteral ketorolac and risk of gastro–intestinal and operative site bleeding. A postmarketing surveillance study. JAMA. 1996;275:376–382.
4. Katz WA. Cyclooxygenase–2–selective inhibitors in the management of acute and perioperative pain. Cleve Clin J Med. 2002;69{suppl I): S165–S175.
5. RuorT G, Lema M. Strategies in pain management: new and potential indications for COX–2 specific inhibitors. J Pain Symptom Manage. 2003;25(2 suppl):S2l–S31.
6. Rainsford KD, Bevilacqua M, Dallegri F, et al. Pharmacological properties of nimesulide. In: Rainsford KD, ed. Nimesulide. Actions and Uses. Basel:Birkhauser; 2005:133–244.
7. Rainsford KD. Members of the Consensus Report Group on Nimesulide. Nimesulide–a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res Opin. 2006;22:1161–1170.
8. Bianchi M, Broggini M. A randomised, double–blind, clinical trial comparing the efficacy of nimesulide, celecoxib and rofecoxib in osteoarthritis of the knee. Drugs. 2003;63(suppl 1):37—46.
9. Herrera JA, Gonzalez M. Comparative evaluation of the effectiveness and tolerability of nimesulide versus rofecoxib taken once a day in the treatment of patients with knee osteoarthritis. Am J Ther. 2003; 10:468^172.
10. Bourgeois P, Dreiser RL, Lequesne MG, et al. Multicentre doubleblind study to define the most favourable dose of nimesulide in terms of efficacy/safety ratio in the treatment of osteoarthritis. Eur L Rheum Inflam. 1994;14:39–50.
11. Lucker PW, Pawlowski C, Friederick 1, et al. Double–blind, randomised, multi–centre clinical study evaluating the efficacy and tolerability of nimesulide in comparison with etodolac in patients suffering from osteoarthritis of the knee. Eur J Rheum In/lam, 1994;14:29–38.
12. Pohjolainen T, Jekunen A, Aulio L, et al. Treatment of acute low back pain with the COX–2–selective anti–inflammatory drug nimesulide: results of a randomized, double–blind comparative trial versus ibuprofen. Spine. 2000;25:1579–1585.
13. Dreiser RL, Riebenfeld D. A double–blind study of the efficacy of nimesulide in the treatment of ankle sprain in comparison with placebo. Drugs. 1993;46(suppl 1):183–186.
14. Jcnoure P, Gorshewsky O, Ryf C, et al. Randomized, double–blind, multicenter study of nimesulide vs. diclofenac in adults with acute sport injuries. J Clin Res. 1998;1:343–356.
15. Shah AA, Thjodleifsson B, Murray FE, et al. Selective inhibition of COX–2 in humans is associated with less gastrointestinal injury: a comparison of nimesulide and naproxen. Gut. 200l;48: 339–346.
16. Huskisson EC, Macciocchi A, Rahlfs VW, et al. Nimesulide versus diclofenac in the treatment of osteoarthritis of the hip or knee: an active controlled equivalence study. Curr Ther Res. 1999;60: 253–265.
17. Marbet GA, Yasikoff Strub ML, Macciocchi A, et al. The effect of nimesulide versus placebo on hemostasis in healthy volunteers. Eur J Clin Pharmacol. 1998;54:383–387.
18. Zuckermann M, Panconesi R, Scaricabarozzi I, et al. Clinical efficacy and tolerability of nimesulide compared with naproxen in the treatment of posthaemorrhoidectomy pain and inflammation. Drugs. 1993;46(suppl 1):177–179.
19. Coscarelli S, Scaricabarozzi 1, Nava ML, el al. A comparison of nimesulide and ketoprofen in the prevention and treatment of painful postoperative inflammatory complications of ear, nose and throat surgery. Drugs. 1993;46(suppl 1);174–176.
20. Pierleoni P, Tonelli P, Scaricabarozzi I. A double–blind comparison, of nimesulide and ketoprofen in dental surgery. Drugs. 1993; 46(suppll):168–170.
21. Ragot JP, Monti T, Macciocchi A. Controlled clinical investigation of acute analgesic activity of nimesulide in pain after oral surgery. Drugs. 1993;46(suppl 1):162–167.
22. Ramella G, Costagli V, Vetere M, et al. Comparison of nimesulide and diclofenac in the prevention and treatment of painful inflammatory postoperative complications of general surgery. Drugs. 1993; 46(suppl 1): 159–161.
23. Aho M, Kokki H, Nikanne E. Nimesulide versus ibuprofen for postoperative tonsillectomy pain. Clin Drug Inv. 2003;23:651–660.
24. Code WE, Yip RW, Rooney ME, et al. Preoperative naproxen sodium reduces postoperative pain following arthroscopic knee surgery. Can J Anaesth. 1994;41:98–101.
25. Pedersen P, Nielsen KD, Jensen PE. The efficacy of Na–naproxen after diagnostic and therapeutic arthroscopy of the knee joint. Arthroscopy. 1993;9:170–173.
26. Rasmussen S, Thomsen S, Madsen SN, et al. The clinical effect of naproxen sodium after arthroscopy of the knee: a randomised, double blind, prospective study. J Arthr Rel Surg. 1993;9: 375–380.
27. Brown CR, Sevelius H, Wild V. A comparison of single doses of naproxen sodium, morphine sulphate and placebo in patients with postoperative pain. Curr Ther Res. 1984;35:511–518.
28. Ouellette RD. Naproxen sodium vs. acetaminophen plus codeine in postsurgical pain. Curr Ther Res. 1986;39:839–845.
29. Baumgartner H. The comparative efficacy of naproxen sodium and pirprofen in the treatment of postoperative pain. J Int Med Res. 1987;15:179–187.
Источник
Лечение после удаления грыжи не менее важно, чем до операции. Послеоперационный реабилитационный период является определяющим в том, насколько эффективно было удаление. Правильно организованная реабилитация значительно сократит риск возникновения каких-либо осложнений у больного.
Реабилитация подразделяется на несколько этапов:
- Ранний период – послеоперационное лечение на протяжении 1-2 недель.
- Отсроченный период – это лечение от 2-х недель до 2 месяцев.
- Отсроченный период – лечение начинается спустя 2 месяца после перенесенной операции и длится всю жизнь.
Все 3 периода не включают каких-то строгих правил, которых необходимо придерживаться. Все будет зависеть от того, как именно была проведена операция по удалению грыжи, а также от особенностей организма пациента и того, насколько сложным было само заболевание.
Направления лечения:
- устранение болей;
- полноценное восстановление функционирования организма;
- укрепление опорно-двигательного аппарата.
Комплекс действий при лечении:
- применение медицинских препаратов;
- физиотерапия;
- разгрузка позвоночника;
- лечебная гимнастика;
- пребывание в лечебных санаториях;
- ношение специального корсета, который призван предотвращать рецидив грыжи.
Терапия: от медикаментов до массажа
Медикаментозное лечение направлено на устранение болей, снижение депрессивного состояния, которое может возникать в послеоперационный период. Чтобы пациент перестал испытывать болевые ощущения, применяют противовоспалительные препараты. Рекомендованы Аэртал, Нимесил или Мовалис. Для восстановления кровообращения могут быть назначены Трентал или Пикамилон. Если пациент испытывает онемение конечностей, врач может прописать ему прием Сирдалуда или Мидокалма.
В реабилитационный период может быть назначено иглоукалывание. Как правило, его проводят спустя несколько месяцев после операции, как только на теле пациента затянутся швы. Такая процедура направлена на предотвращения воспалительных процессов, ею лечится боль и защемления. Практика эта вполне эффективная, а результат ощущается уже спустя несколько процедур. Безусловно, важно проводить и специальные лечебные массажи, благодаря которым у пациента восстановится кровообращение, а все питательные вещества начнут быстрее усваиваться.
Физическая активность
Пациент и сам должен производить определенные действия по улучшению своего состояния. Врач может посоветовать комплекс специальных физических упражнений, которые можно делать ежедневно в домашних условиях. Их выполняют в положении лежа на спине с небольшим валиком под головой:
- Подтянуть к корпусу ноги, голову слегка приподнять, а кисти рук сжать в кулаки.Далее неторопливо вернуться в исходное положение.
- Подтянуть колени к грудной клетке, при этом должно возникнуть напряжение в области ягодиц. Задержаться в таком положении на несколько секунд. Повторить 10 раз.
- Согнуть ноги в коленях и расставить их как можно шире. Затем постараться достать правым коленом до левой ступни и наоборот. Нужно стараться не отрывать плеч от пола.
- Положить голову на ладони и согнутые в коленях ноги попеременно наклонять сначала в одну сторону, потом в другую.
- Вытянуть прямые руки вверх ладонями вперед и не отрывая таза от поверхности, достать правой ладонью левой руки и наоборот.
- Лечь прямо, руки вытянуть вдоль корпуса и опираясь на пятки, слегка приподнять таз несколько раз.
- Согнуть ноги в коленях и поставить их на ширине плеч, постараться достать руками до колен, отрывая корпус от поверхности.
- Упражнение «велосипед» как нельзя кстати в послеоперационный период. Нужно попеременно совершать сгибание и разгибание коленного сустава, имитируя езду на велосипеде.
- Лечь на живот, опереться подбородком на кисти рук, которые необходимо согнуть в локтях, опереться стопами в пол и постараться приподнять корпус за счет работы ягодичной мышцы.
- Занять положение лицом вниз, согнуть правую ногу, одновременно повернув голову к левому плечу, затем проделать то же упражнение в противоположную сторону.
- В том же положении подтянуть правое колено к правому локтю, затем левое колено к левому локтю.
Все упражнения необходимо делать не спеша, без резких выпадов и движений, тогда они принесут пользу.

Режим питания после удаления грыжи
Некоторый период после операции следует придерживаться определенной диеты, чтобы восстановление организма шло эффективно. Первое, что здесь посоветуют врачи, – это включить в свой рацион продукты, в которых содержится много кальция. Пациенту нужно будет налегать на рыбу, капусту, молочные продукты. Из сладкого нужно будет есть то, что содержит желатин или агар агар – это мармелад и желе. От алкоголя в период реабилитации стоит совсем отказаться.
Существует диета для больных, перенесших операцию по удалению грыжи в брюшной полости:
- необходимо отказаться от твердой пищи;
- можно употреблять только нежирные бульоны;
- пить можно фруктовый кисель;
- желательно пить отвары на основе шиповника или коричневого риса.
Чем хороша такая диета, поможет ли она лечиться? Соблюдая вышеуказанные правила, пациент оградит себя от значительной нагрузки на внутренние органы и убережет свой желудочно-кишечный тракт. Принимать пищу нужно каждые несколько часов небольшими порциями. Необходимо тщательно подбирать продукты, иначе есть риск возникновения запоров, а это нежелательно в данной ситуации. Приветствуются белковые продукты. Необходимо пить много воды, в среднем до 2 л, чтобы избежать обезвоживания. Кроме простой воды можно употреблять травяные отвары, зеленый чай.
Пока организм восстанавливается, нельзя есть мучное, яблоки, молоко и газированные напитки, любые бобовые и белокочанную капусту.
Постановка на учет по инвалидности
Удаление грыжи, особенно межпозвоночной – это сложная операция, после которой человек нередко теряет трудоспособность частично или полностью. Иногда даже обычные дела по дому становятся для больного испытанием. Однако инвалидность присваивается, когда человек остается в крайне тяжелом состоянии. Для получения такого статуса оформляются необходимые документы и проводится медицинская экспертиза, после чего принимается решение о присвоении больному той или иной степени инвалидности.
Выше были описаны методы как лечиться после операции по удалению грыжи. Если придерживаться рекомендаций лечащего врача, то реабилитация после операции пройдет успешно.
Источник